셀트리온, 류마티스 관절염 치료제 악템라 시밀러 '앱토즈마' 허가
페고자페르민 3상, MASH 환자 중 섬유화 2~3단계 진행 환자 대상
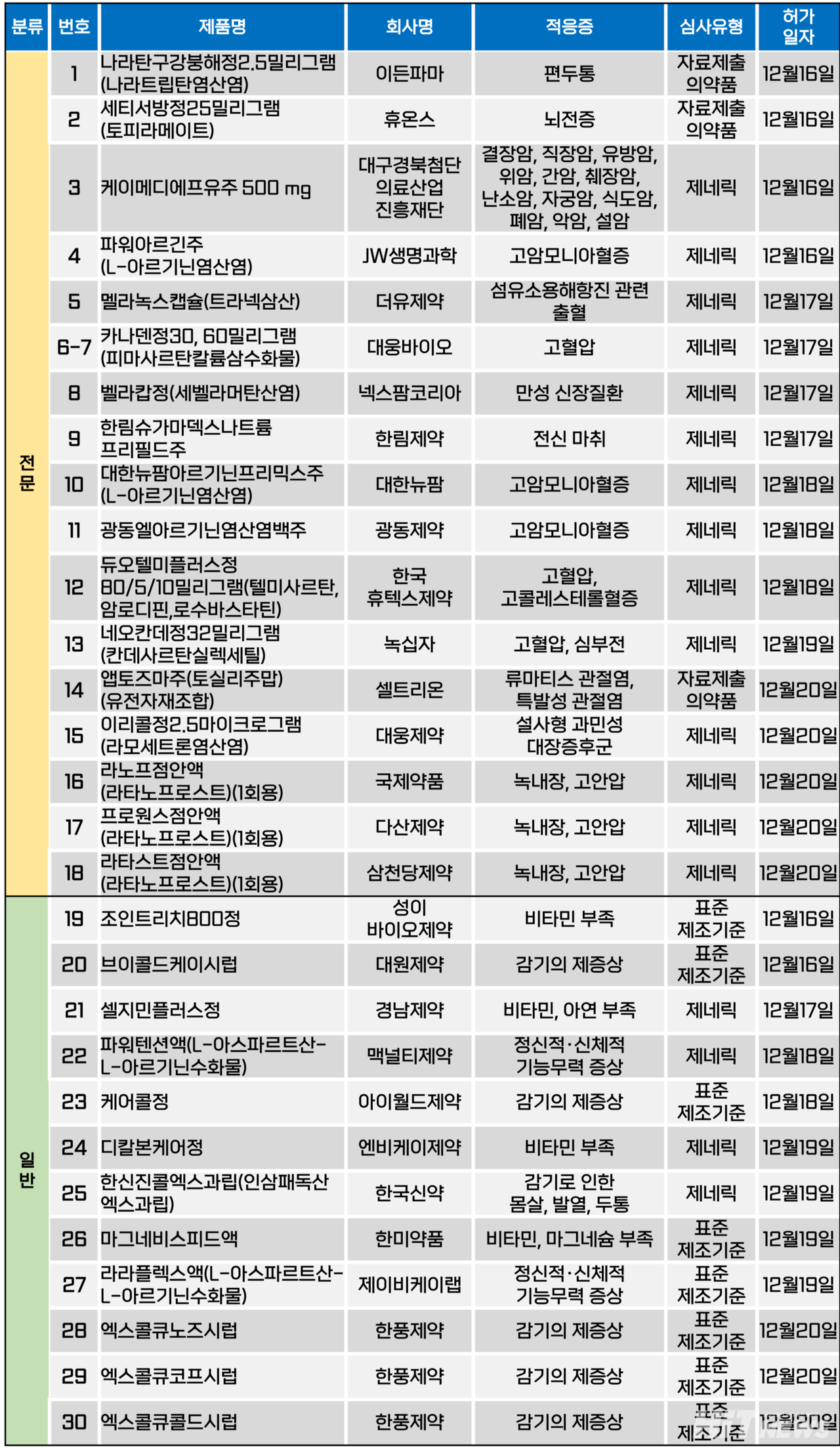
지난주(12월 16~20일) 총 30개 품목이 식품의약품안전처에서 품목허가를 받았다. 전문의약품은 18개, 일반의약품은 12개 품목이다. 이들은 편두통, 뇌전증, 고혈압, 고콜레스테롤혈증, 심부전, 류마티스 관절염, 녹내장 등 다양한 적응증으로 허가됐다.
류마티스 관절염 치료제 악템라(성분 토실리주맙) 슬롯사이트 2025년로 셀트리온이 개발한 앱토즈마(연구명 CT-P47)가 지난 20일 국내 허가됐다. 악템라는 현재 정맥주사(IV) 제형과 피하주사(SC) 제형으로 모두 출시돼 있는데, 이번 허가는 정맥주사 제형을 대상으로 이뤄졌다.
셀트리온은 글로벌 임상 3상을 통해 류마티스 관절염 환자 471명을 대상으로 앱토즈마(IV)와 악템라(IV) 간 유효성, 약력학, 약동학 및 안전성을 비교한 바 있다.
연구진은 앱토즈마 투여군과 악템라 투여군은 류마티스 관절염 활성도 주요 지표인 베이스라인 대비 'DAS28(Disease activity score 28)'값의 변화를 1차 유효성 평가변수로 측정했다.
임상 결과, DAS28 값은 두 약제 간 차이가 사전에 정의한 동등성 기준에 부합했다. 이를 통해 오리지널 의약품 대비 유효성, 동등성, 약동학 및 안전성을 확인했다는 것이 회사 측의 설명이다.
또 24주차에 오리지널군과 슬롯사이트 2025년 군의 무작위 배정이 다시 한번 진행됐는데, 24~32주차까지 △CT-P47 투약군 △오리지널 의약품 투여를 유지한 투약군 △오리지널 의약품 투여 후 CT-P47로 전환한 교체 투약군 등 세 그룹간 유효성, 약동학, 안전성, 면역원성을 평가하는 2차 유효성평가변수에서도 결과가 유사한 것으로 나타났다.
회사 측은 이번 허가를 바탕으로 향후 의료진이 환자 상태와 편의를 고려해 선택 처방할 수 있도록 정맥 및 피하주사 제형 모두를 출시할 계획이다.
아울러 회사는 국내 외에도 미국, 유럽 등 주요 글로벌 국가에서 앱토즈마의 허가에 주력하고 있다. 지난 1월 미국 FDA, 2월 유럽 EMA를 대상으로 품목허가 신청을 완료했다.
지난 16일 셀트리온은 EMA 산하 약물사용자문위원회(CHMP)로부터 악템라 슬롯사이트 2025년 '앱토즈마(개발명 CT-P47)', 아일리아 슬롯사이트 2025년 '아이덴젤트(개발명 CT-P42)', 프롤리아-엑스지바 슬롯사이트 2025년 '스토보클로(개발명 CT-P41)'-'오센벨트(개발명 CT-P41)' 등 4개에 대한 유럽 품목허가 승인 권고 의견을 받았다.
회사 관계자는 "CHMP가 단일 기업의 제품 4종을 동시에 대거 승인 권고한 것은 드문 사례로, 셀트리온의 기술력과 개발 역량을 전 세계에 다시 한번 입증할 수 있는 계기가 됐다"며 "이번 허가 권고를 통해 글로벌 시장 내 셀트리온의 위상은 급격히 높아질 것으로 예상되는 만큼, 기대에 부응할 수 있도록 남은 허가 절차와 상업화에 만전을 기할 방침"이라고 말했다.
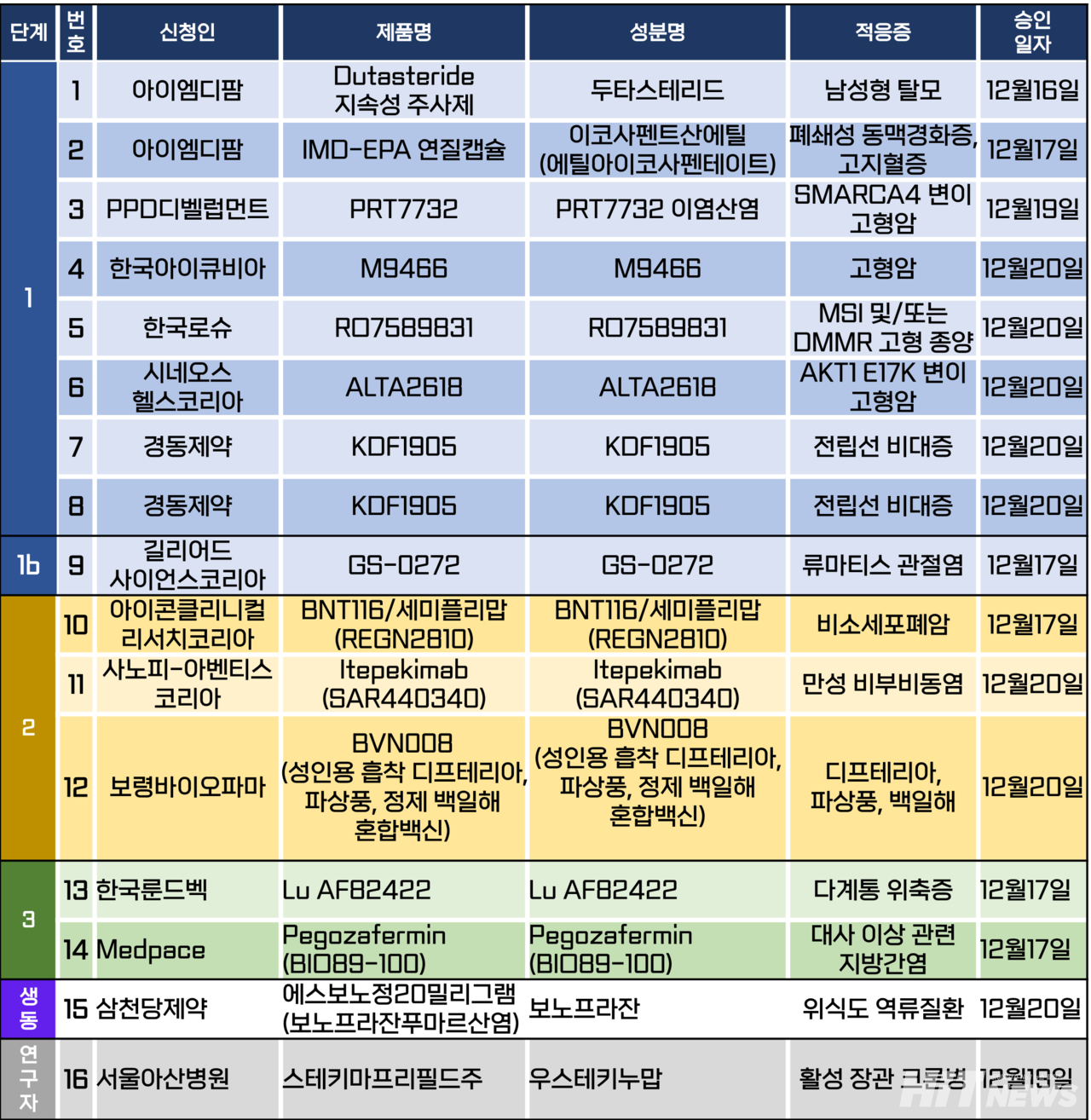
임상시험계획은 총 16건이 승인됐다. 세부적으로 △1상 8건 △1b상 1건 △2상 3건 △3상 2건 △생물학적 동등성 1건 △연구자 임상 1건 등이다. 이 임상시험들은 남성형 탈모, 폐쇄성 동맥경화증, 전립선 비대증, 류마티스 관절염, 만성 부비동염, 다계통 위축증, 대사 이상 관련 지방간염(MASH) 등 질환을 대상으로 승인됐다.
미국 생명공학기업 '89슬롯사이트 2025년(89BIO)'가 개발 중인 대사이상 관련 지방간염(MASH) 치료 신약 후보물질 '페고자페르민(Pegozafermin)'의 국내 3상 임상시험계획이 승인됐다.
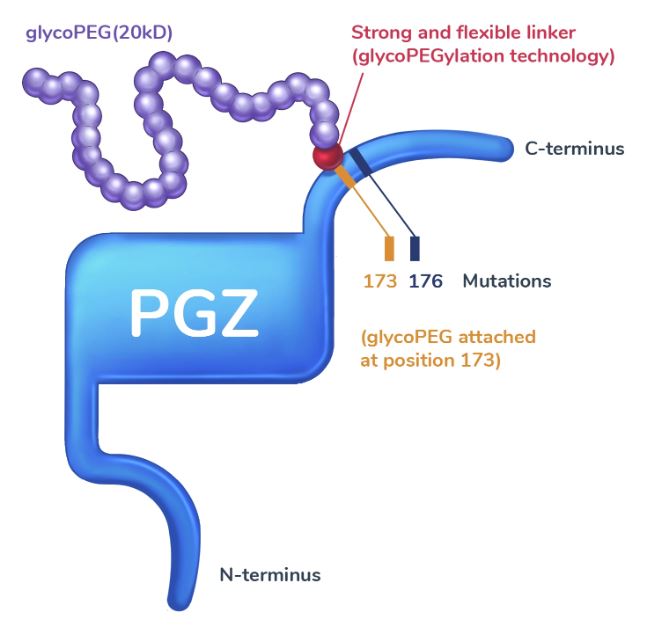
페고자페르민은 89슬롯사이트 2025년가 MASH와 중증 고중성지방혈증(SHTG)을 치료하기 위해 개발하고 있는 피하주사 제형의 신약 물질로, 섬유아세포성장인자 21(FGF 21) 유사체로 개발된 물질이다.
FGF21은 에너지 소비, 체내 포도당 및 지질 대사를 조절하는 데 관여하는 내인성 호르몬으로, 간, 심장, 췌장, 신장, 뇌, 근육 등 주요 장기에 주요 대사 조절자로서 역할을 수행한다. 다만, 내인성 호르몬 특성상 반감기가 짧아 치료제 사용에 어려움을 겪어 왔다.
89슬롯사이트 2025년는 FGF21의 짧은 반감기를 극복하기 위해 'GlycoPEGylation'기술을 활용했다. 이 기술을 통해 페고자페르민은 20kD 크기의 'GlycoPEG'를 부착하고 있어 분해가 억제될 수 있다.
이번에 승인된 3상 임상(연구명 ENLIGHTEN-fibrosis)은 MASH 환자 중에서도 섬유화(Fibrosis)가 진행된 환자(2~3단계)를 대상으로 페고자페르민 2회 투여 요법과 위약 간 유효성 및 안전성을 평가한다.
연구진은 1차 유효성평가변수를 52주 시점 △MASH 악화 없거나 섬유화지표 1점 이상 개선 △섬유화 악화 없거나 MASH 해소(resolution)되는 환자의 비율로 설정했다.
국내 35명(글로벌 1050명)의 환자 참여를 목표로 진행되며 △인하대 의대부속병원 △이화여대 의대부속목동병원 △가톨릭대 서울성모병원 △서울보라매병원 △부산대병원 △영남대병원 △서울대병원 등 의료기관에서 2029년 11월까지 진행될 예정이다.
89슬롯사이트 2025년는 지난 3월 12일(현지시간) 자체 보도자료를 통해 미국에서의 3상 임상 개시를 밝힌 바 있다. 회사는 이 연구 결과로 FDA 신속승인, EMA 조건부 승인을 추진하겠다는 입장이다.
