셀트리온제약, 당뇨병 복합제 '셀트리온알로글립틴피오정' 수출허가
글로피타맙, 지난 6월 FDA서 DLBCL·LBCL 환자 대상 3차 치료제 허가
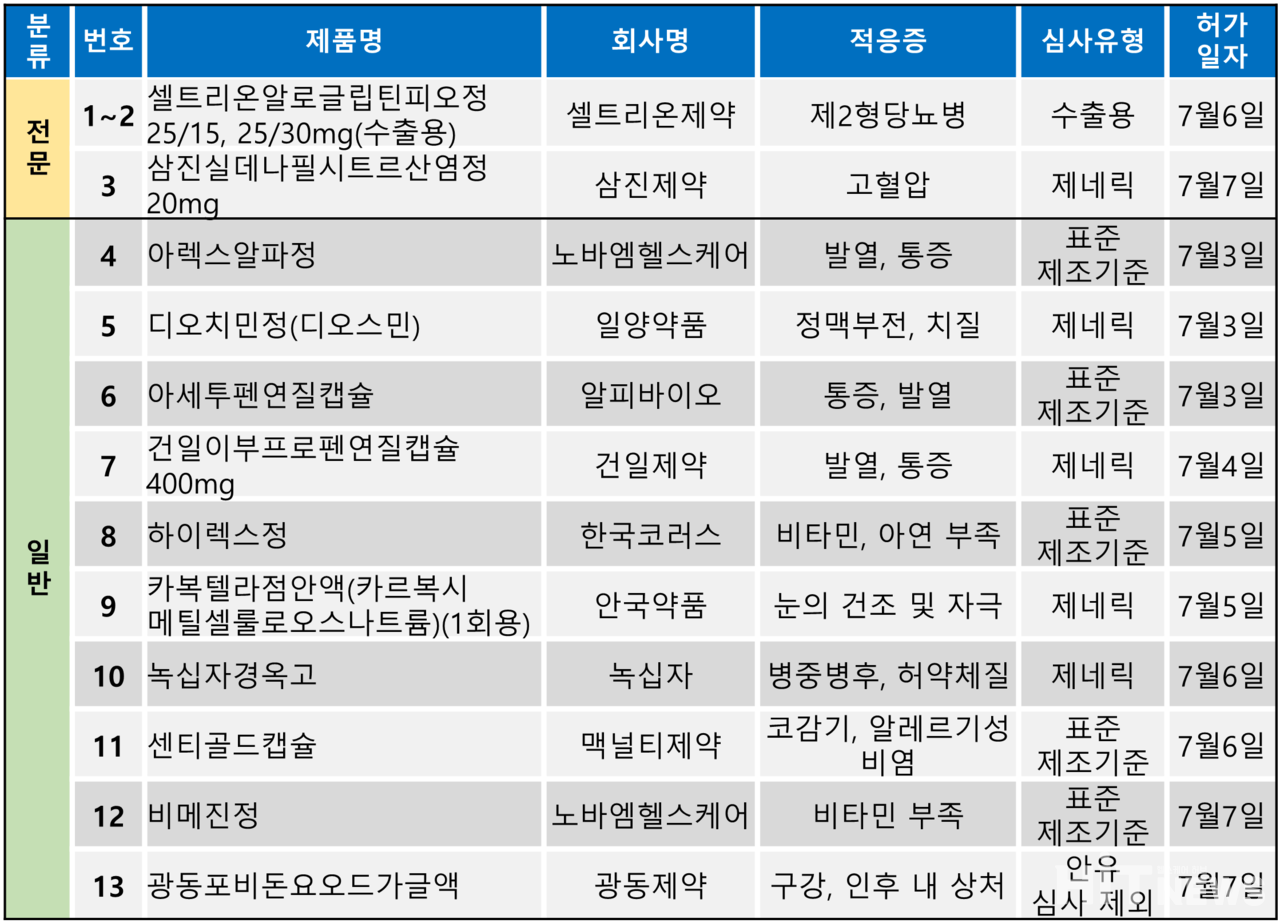
지난주(7월 3~7일) 총 13개 품목이 식품의약품안전처로부터 품목 허가를 받았다. 전문의약품은 3개 품목, 일반의약품은 10개 품목이었다. 허가 품목들은 제2형 당뇨병, 고혈압, 발열 및 통증 등 다양한 적응증으로 허가됐다.
셀트리온제약은 지난 6일 DPP-4 억제제 '알로글립틴'및 TZD 계열 '피오글리타존'성분의 제2형 당뇨병 복합제인 '셀트리온알로글립틴피오정'의 수출용 품목 허가를 받았다. 국내에 알로글립틴 성분 당뇨병 치료제를 보유한 업체는 셀트리온제약뿐이다.
앞서 셀트리온그룹은 일본 다케다제약으로부터 아태지역 제품군을 인수할 당시 '네시나정(성분 알로글립틴)'의 국내 판권을 획득했다. 셀트리온제약은 현재 네시나정라인업으로 네시나엑트정(성분 알로글립틴+피오글리타존) 4개 용량과 네시나메트정(성분 알로글립틴+메트포르민) 3개 용량을 보유하고 있다.
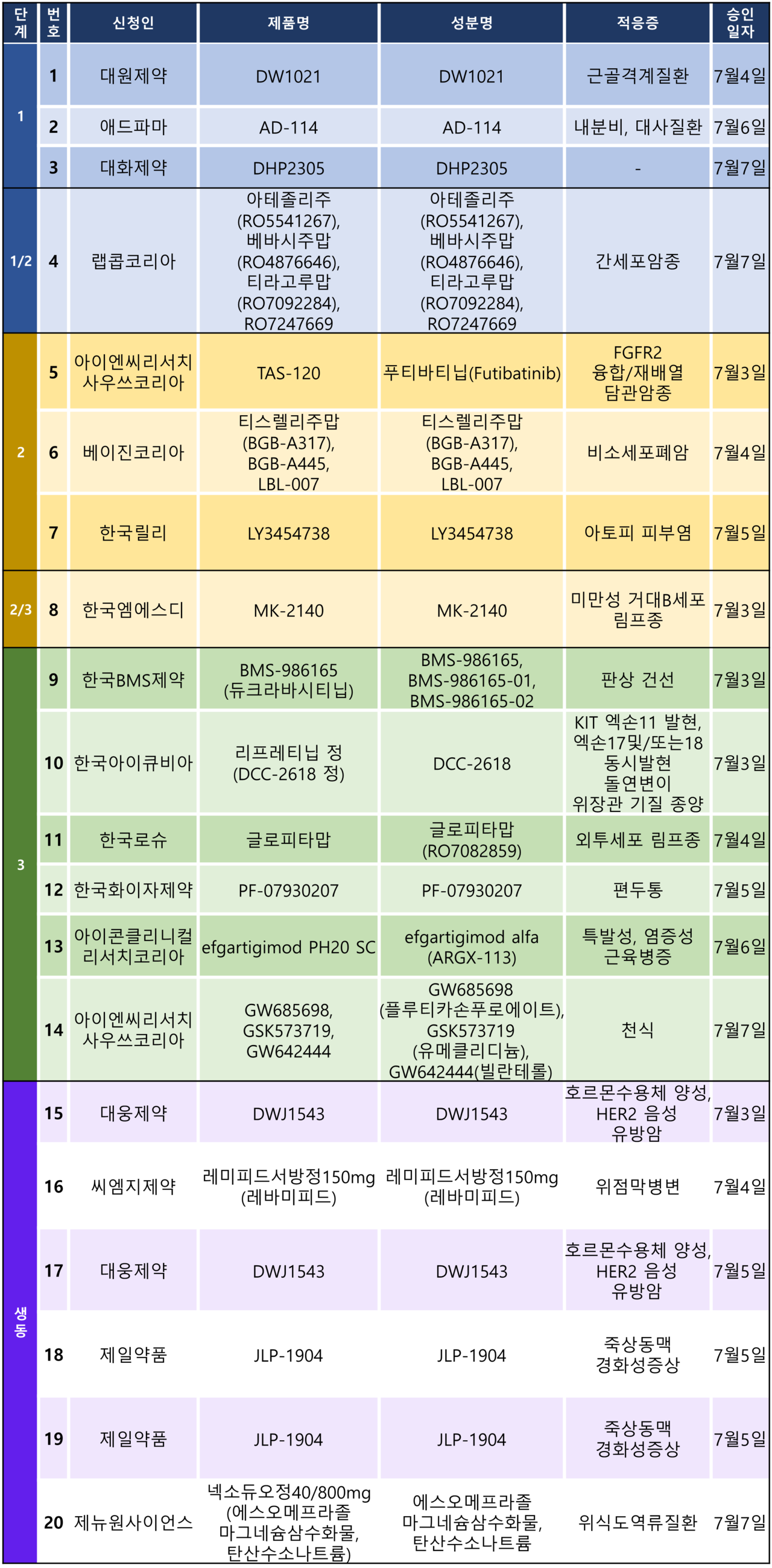
지난주 임상시험계획은 총 20건이 승인됐다. 세부적으로 △1상 3건 △1/2상 1건 △2상 3건 △2/3상 1건 △3상 6건 △생물학적동등성 6건 등이다. 이 임상시험들은 아토피 피부염, 판상건선, 편두통, 천식 등 등 질환과 간세포암종, 담관암종, 위장관암, 비소세포폐암, 외투세포 슬롯사이트 업카지노 등 암종을 대상으로 승인됐다.
로슈가 혈액암 치료제로 개발 중인 CD20xCD3 T세포 관여 이중특이항체(Bispecific antibody) '글로피타맙(미국 제품명 콜롬비)'의 재발성/불응성 외투세포 슬롯사이트 업카지노 환자를 대상으로 한 3상 임상시험계획이 지난 4일 승인됐다.
이번 임상시험은 재발성/불응성 외투세포 슬롯사이트 업카지노 환자에서 글로피타맙 단일제제를 시험자가 선택한 요법과 비교해 평가하기 위한 공개, 다기관, 무작위배정 연구다. 목표 대상자 수는 20명(글로벌 182명)으로 △연세대세브란스병원 △충남대병원 △삼성서울병원 △서울대병원 △서울아산병원 등 5개 의료기관에서 2027년 9월까지 진행될 예정이다.
회사는 이번 임상시험의 1차 유효성 평가변수를 '무진행 생존기간(PFS)'으로 설정했다. 이는 무작위배정부터 악성 슬롯사이트 업카지노에 대한 Lugano 반응 평가 기준에 따라 독립적 중앙 맹검 평가(BIRC)에서 판단한 질병 진행의 첫 발생 또는 모든 원인에 의한 사망까지의 시간으로 정의된다. 이 외에도 2차 유효성 평가변수를 완전관해율(CR), 객관적 반응률(ORR), 전체 생존율(OS) 등으로설정했다.
한편 로슈는 지난 6월 16일(현지 시각) 미국 식품의약국(FDA)으로부터 글로피타맙의 품목 허가를 획득했다. FDA는 글로피타맙을 '2차 이상의 전신요법 치료를 받은 적 있는 재발성 또는 불응성 미만성 거대 B세포 슬롯사이트 업카지노(DLBCL) 또는 소포 슬롯사이트 업카지노에서 발생한 거대 B세포 슬롯사이트 업카지노(LBCL)' 환자를 대상으로 허가했다.
현재 우리나라에서도 다양한 적응증을 대상으로 한 임상이 진행 중인데 △재발성/불응성 미만성 거대 B세포 슬롯사이트 업카지노을 대상 3상 시험(글로피타맙+젬시타빈+옥살리플라틴)과 2상 시험(글로피타맙+포셀티닙+레날리도마이드) △재발성/불응성 성숙 B세포 비호지킨 슬롯사이트 업카지노 1/2상(글로피타맙) △다발성경화증 1상(글로피타맙+오크렐리주맙) 등이 실시되고 있다.

