코아팜바카라 온라인, 정제형 시트룰린말산엽 제제 '비고비정' 허가
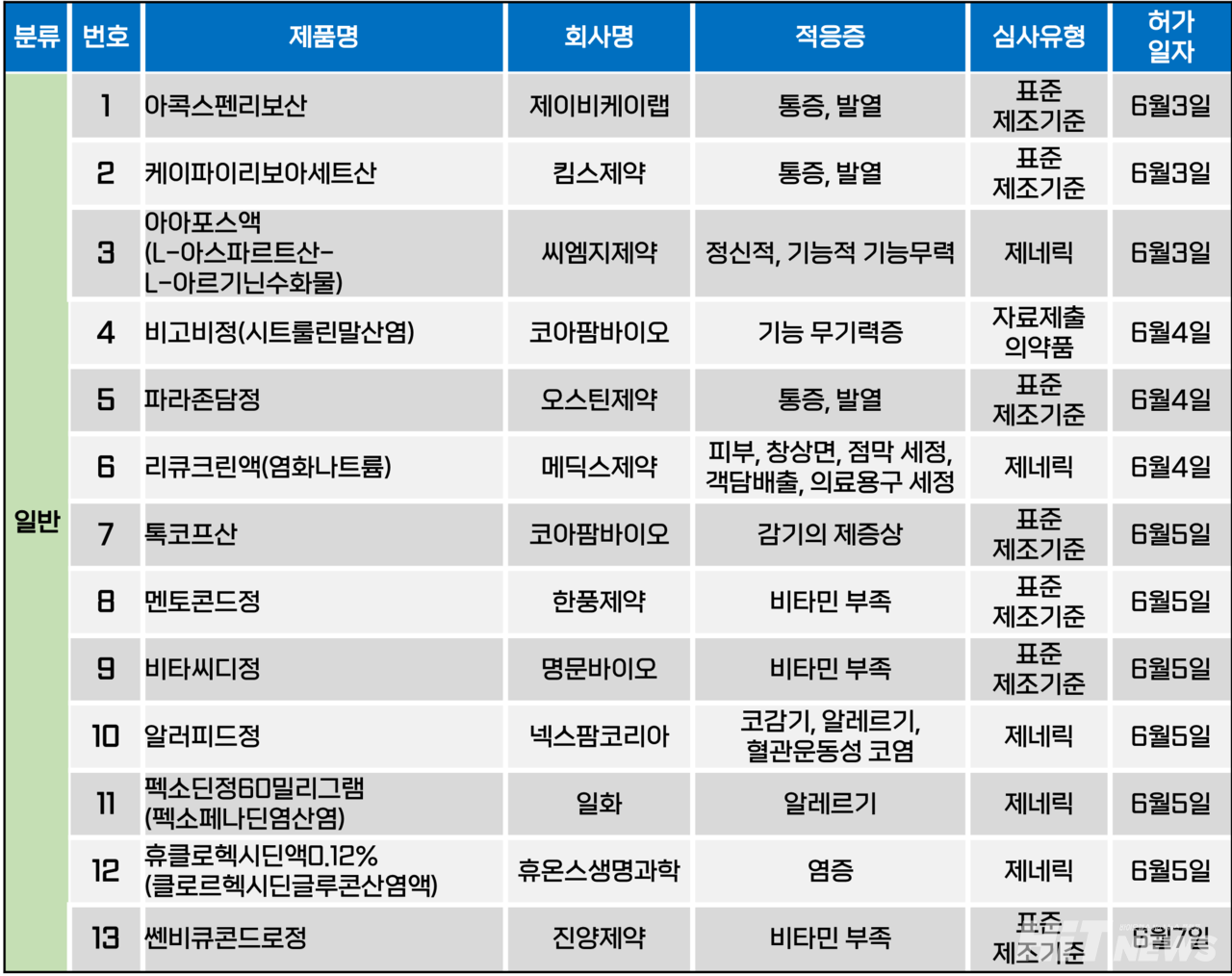
지난주(6월 3~7일) 총 13개 품목이 식품의약품안전처로부터 품목허가를 받았다. 모두 일반의약품이었으며 통증, 발열, 기능무력, 감기의 제증상, 알레르기 등 다양한 적응증으로 허가됐다.
코아팜바카라 온라인는 지난 4일 통상 액제로 개발돼 왔던 시트룰린말산염 성분 제제를정제로 변경한 '비고비정'을 허가 받았다. 해당 성분은 기능 무기력증 치료제로 사용된다.
비고비정의 수탁생산을 맡은 킴스제약은 2022년 12월 27일 국내에서 처음으로 시트룰린말산염 성분 정제 '시너지아정'을 허가 받고, 2023년 6월부터 이 제품을 출시했다. 회사는 과거 중소기업벤처부로부터 '무기력증 치료용 말산시트룰린의 환자 복용 순응도 개선을 위한 정제 개발(세계최초)'이라는 연구 과제를 수주 받아 시너지아정을개발했다.
이후 영일제약도 지난 1월 17일 동일 제형, 동일 성분의 '에너비정'을 허가 받았는데, 이 또한 킴스제약이 생산하는 품목이다.
이번 허가로 국내 시트룰린말산염 성분 의약품은 32개 품목으로 확대됐으며, 이 중 29개는알루미늄 호일 파우치에 들거나 병 속에 들어있는 액제형 의약품이다.
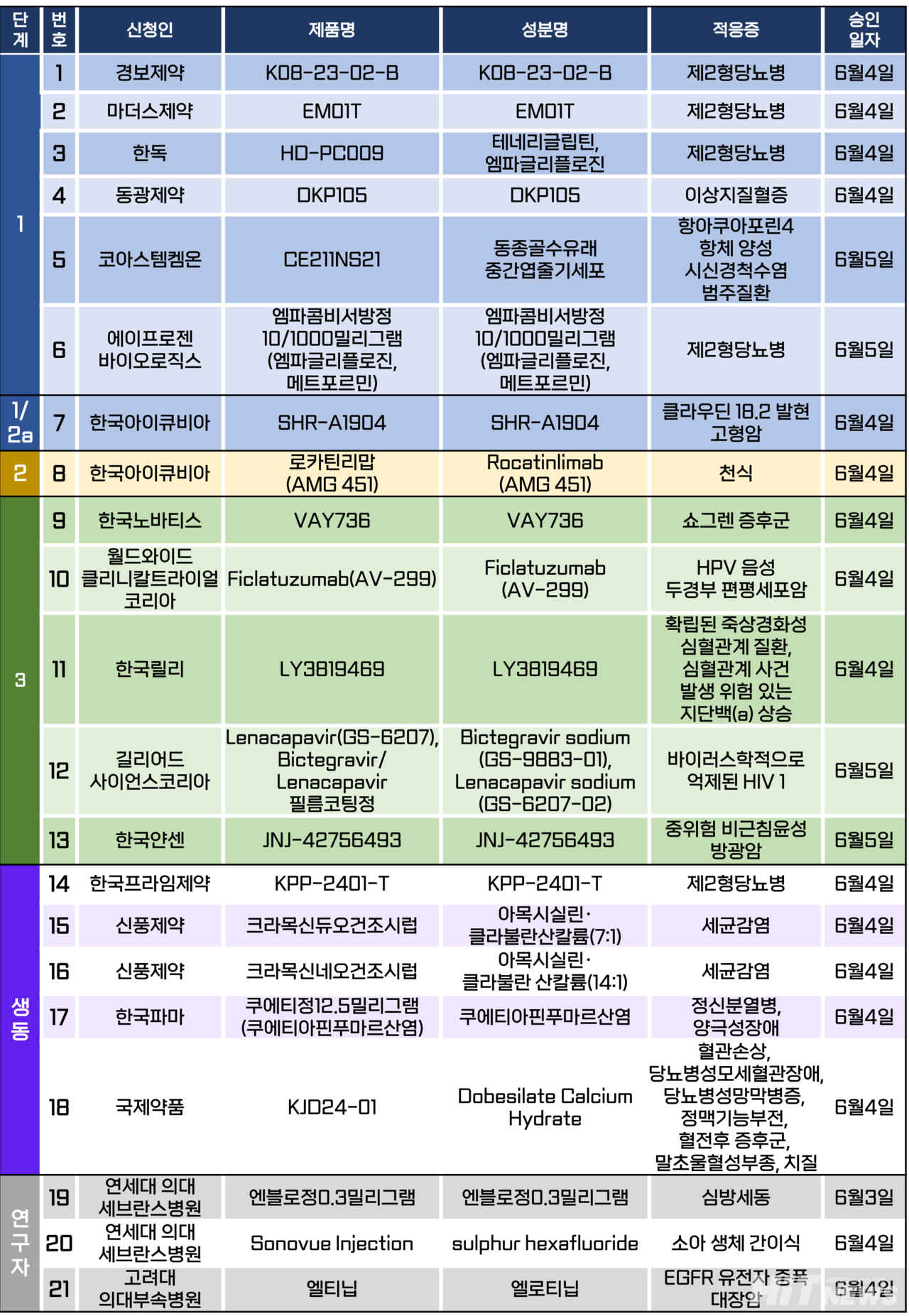
임상시험계획은 총 21건이 승인됐다. 세부적으로 △1상 6건 △1/2a상 1건 △2상 1건 △3상 5건 △생물학적 동등성 3건 △연구자임상 3건 등이다. 이 임상시험들은 제2형당뇨병, 이상지질혈증, 천식, 쇼그렌 증후군, HIV 감염 등 질환과 클라우딘 18.2 발현 고형암, 중위험 비근침윤성 방광암 등 암종을 대상으로 승인됐다.
LG화학이 인수한 미국의 제약기업 '아베오(AVEO)'가 개발 중인 두경부암 치료 신약물질 '피클라투주맙(Ficlatuzumab·연구코드명 AV-299)'의 3상 임상시험계획이 지난 4일 승인됐다.
이번 국내 3상 임상(연구명 FIERCE-HN)은 이 연구의 일환으로, 재발성 또는 전이성(R/M) 인유두종바이러스(HPV) 음성 두경부 편평세포암 참여를 대상으로 얼비툭스(성분 세툭시맙)와 피클라투주맙의 병용요법의 안전성 및 유효성을 확인하는 다기관, 무작위배정, 이중 눈가림, 위약 대조 연구다.
이번 연구는 24명(글로벌 410명)의 환자를 목표로 2027년 4월까지 △아주대병원 △연세대 의대 세브란스병원 △서울대병원 △ 고려대 의대부속병원 △삼성서울병원 △계명대 동산병원 △가톨릭대 은평성모병원 등 의료기관에서 진행될 예정이다.
연구진은 이번 임상시험의 일차유효성평가변수를 전체생존기간(OS)으로 설정했다. 또, 이차유효성평가변수로 △무진행생존기간(PFS) △객관적반응률(ORR) △질병 조절률(DCR) △반응 지속기간(DOR) △이상반응의 발생률 및 중증도 △실험실검사수치 △혈청전환 상태를 근거로 피클라투주맙에 대한 항 약물 항체(ADA)의 존재 및 PK, 유효성 및 안전성에 대한 ADA의 잠재적 영향 평가 △ADA가 양성인 경우 nAB의 존재 및 피클라투주맙-HGF 결합에 대한 ADA의 잠재적 간섭 평가 등으로 정했다.
한편 피클라투주맙은 2022년 LG화학이 아베오를 인수하며 도입한 신약 파이프라인 중 하나로, 종양을 키우는 간세포 성장인자(Hepatocyte growth factorㆍHGF)의 작용을 억제하는 기전의 단일항체 기반 표적항암제다. 미국 FDA로부터 2상 임상 결과를 기반으로 '패스트 트랙(Fast track)'약물로 지정된 바 있으며, 지난 1월 미국에서 첫 환자 등록 후 연구를 진행 중에 있다.

