셀트리온, 스텔라라 바카라 가상 머니 사이트시밀러 '스테키마' 정맥제형 허가
Nav 1.7 저해제, 신경병성·골관절염·수술 후 통증 등 적응증으로 개발
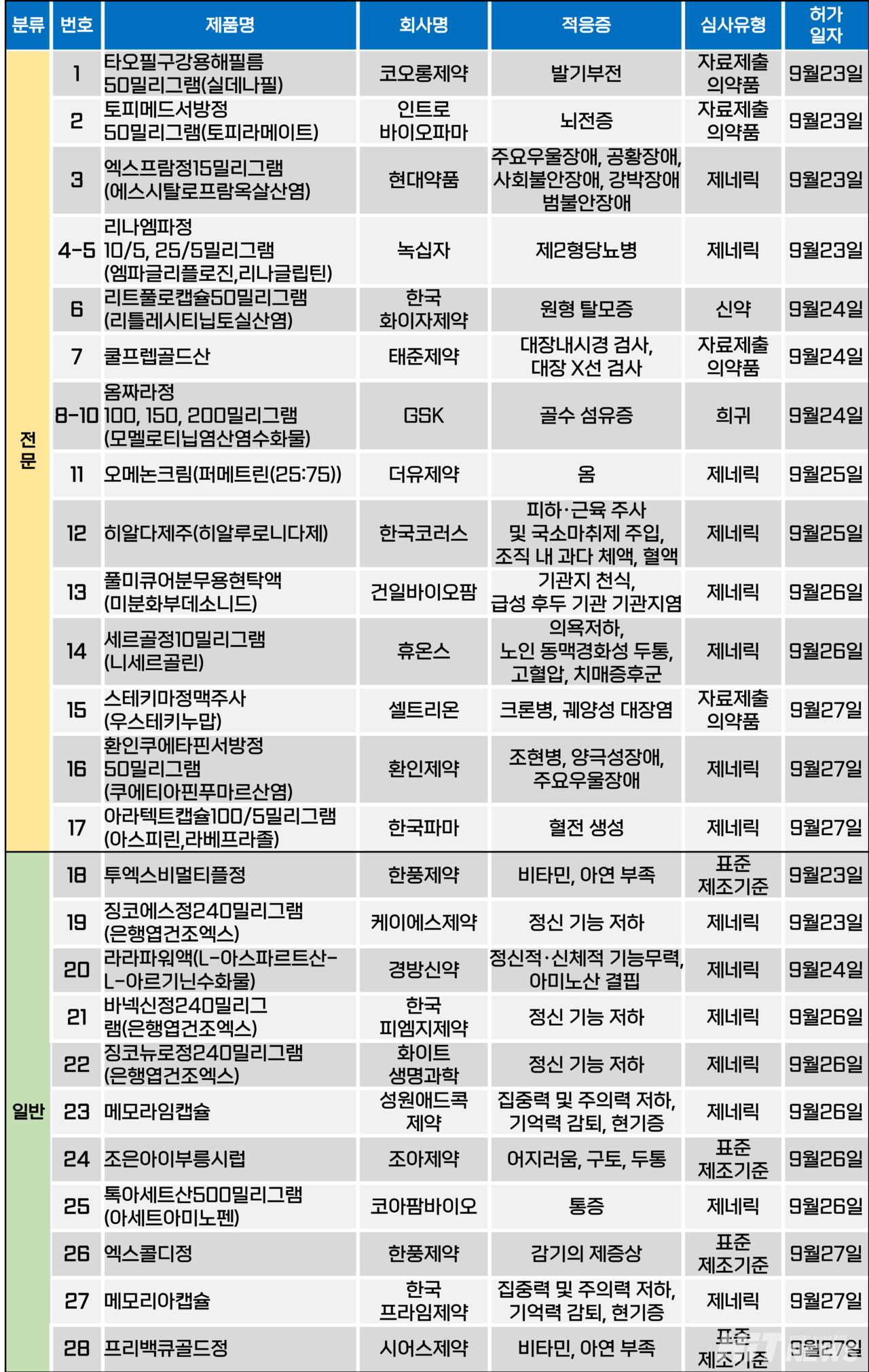
지난주(9월 23~27일) 총 28개 품목이 식품의약품안전처에서품목허가를 받았다. 전문의약품은 17개, 일반의약품은 11개 품목이다. 이들은 발기부전, 뇌전증, 제2형당뇨병, 우울증, 원형탈모증, 골수 섬유증 등 다양한 적응증으로 허가됐다.
셀트리온이이 개발한 자가면역질환 치료제 스텔라라 바카라 가상 머니 사이트시밀러 '스테키마(성분 우스테키누맙)'의 정맥주사(IV) 제형이 지난 27일 국내 허가됐다. 스테키마는 IL-12(인터루킨-12)와 IL-23(인터루킨-23)을 억제하는 항체 의약품이다.
스테키마 정맥주사는 스텔라라 정맥주사와 동일하게 코르티코스테로이드제 또는 면역억제제 또는 종양괴사인자(TNF-α) 저해제 치료에 반응을 나타내지 않거나(궤양성 대장염의 경우 인테그린 저해제 포함), 내약성이 없는 경우 또는 이러한 치료방법이 금기인 중등증에서 중증의 활성 크론병 및 궤양성 대장염의 치료 목적으로 사용할 수 있다.
회사는 이번 허가에 앞서 지난 6월 프리필드시린지 제형의 스테키마를 허가받은 바 있다. 프리필드시린지 제형은 △판상 건선(6세 이상 소아 포함) △건선성 관절염 △크론병 △궤양성 대장염 등 정맥제형에 비해 더 넓은 적응증 범위를 가지고 있다.
셀트리온은 스테키마의 허가로 자사 자가면역질환 치료제 범위를 더욱 확장하게 됐다. 현재 회사는 램시마, 램시마SC, 유플라이마 등 TNF-α 억제제와 인터루킨(IL) 억제제인 스테키마도 허가를 받으면서 치료 대상 환자 범위를 더욱 확대해 나가고 있다. 국내 유통은 자회사인 셀트리온제약이 담당한다.
또, 회사는 캐나다, 유럽, 영국 등 주요 국가들의 허가를 획득하며 시장 영향력 또한 넓혀 나가고 있는 중이다. 의약품 시장조사 기관 아이큐비아(IQVIA)에 따르면, 작년 우스테키누맙 성분 제제의 글로벌 시장 규모는 약 26조5200억원으로 추정됐다.
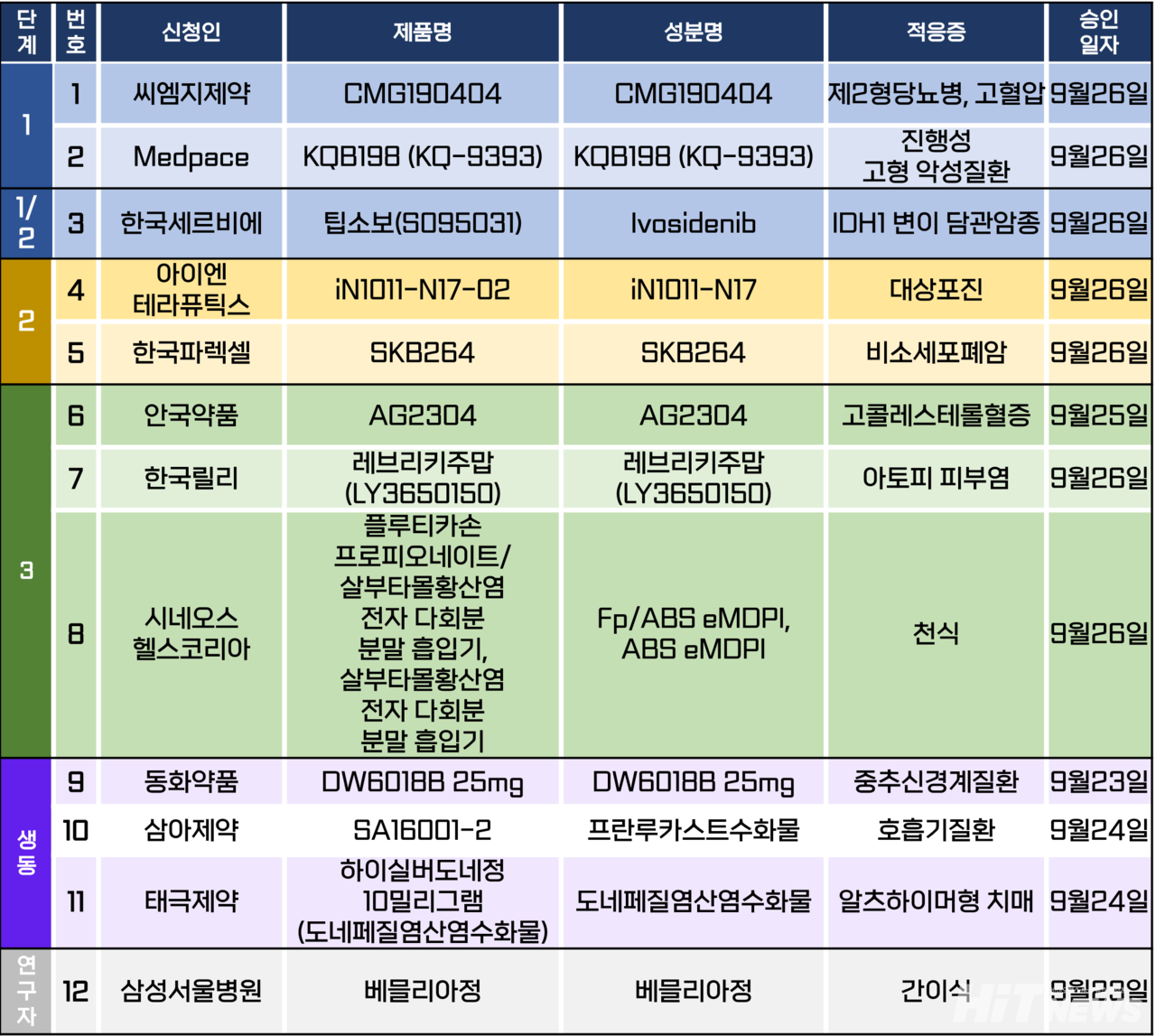
임상시험계획은 총 12건이 승인됐다. 세부적으로 △1상 2건 △1/2상 1건 △2상 2건 △3상 3건 △생물학적 동등성 3건 △연구자임상 1건 등이다. 이 임상시험들은 제2형당뇨병, 고혈압, 대상포진, 고콜레스테롤혈증, 아토피 피부염, 천식 등 질환과 비소세포폐암, 담도암 등 암종을 대상으로 승인됐다.
대웅제약 자회사 아이엔테라퓨틱스가 개발중인 비마약성 진통제 ‘iN1011-N17’의 2상 임상시험계획이 지난 26일 승인됐다.
iN1011-N17는 전압 의존성 이온 나트륨 채널의 일종인 ‘Nav 1.7’를 저해하는 물질로, 기존 마약성 진통제의 부작용으로 통증 관리에 어려움을 겪는 환자들의 만성 통증을 조절하기 위한 약제로서 개발되고 있다.
이번 임상은 대상포진 후 신경통 환자에서 iN1011-N17-02의 안전성, 내약성, 예비 유효성 및 약동학 및 약력학을 평가하기 위한 연구다. 임상시험 진행 의료기관은 아직 공개되지 않았다.
회사는 앞서 iN1011-N17의 1상 임상을 호주에서 진행한 바 있다. 지난 1월 1a상 단회투여 시험을 완료하고, 반복투여 시험인 1b상 임상을 진행중에 있다.
아이엔테라퓨틱스는 Nav 1.7 억제제을 수술 후 통증, 골관절염 통증, 신경병성 통증 등에 사용할 수 있도록 적응증을 확보해 나간다는 입장이다. 약물 메커니즘별로 iN1011-N17(신경병성 통증/골관절염 통증, 경구용), iN1012-N17(수술 후 통증, 주사제), iN1213-N17(신경병성 통증, 외용제) 등으로 나뉘어 개발 중이다.
한편, 신경병증성 통증은 전세계 인구의 약 7~10%가 보유하고 있을 정도로 많은 환자들이 겪고 있는 증상으로, 당뇨병 환자의 20~30%, 대상포진 환자의 10~30%에서 나타난다.
한국보건산업진흥원이 발표한 자료에 따르면, 글로벌 비마약성 진통제 시장 규모는 2022년 기준 약 29조원으로 분석됐으며, 오는 2030년까지 3배 이상 성장한 100조 원 규모를 달성할 것으로 전망됐다.

