니세르골린 성분 제제 6개 품목 허가
아미코젠 관계사 '로피바이오', 미국과 유럽 이어 국내 3상 시작
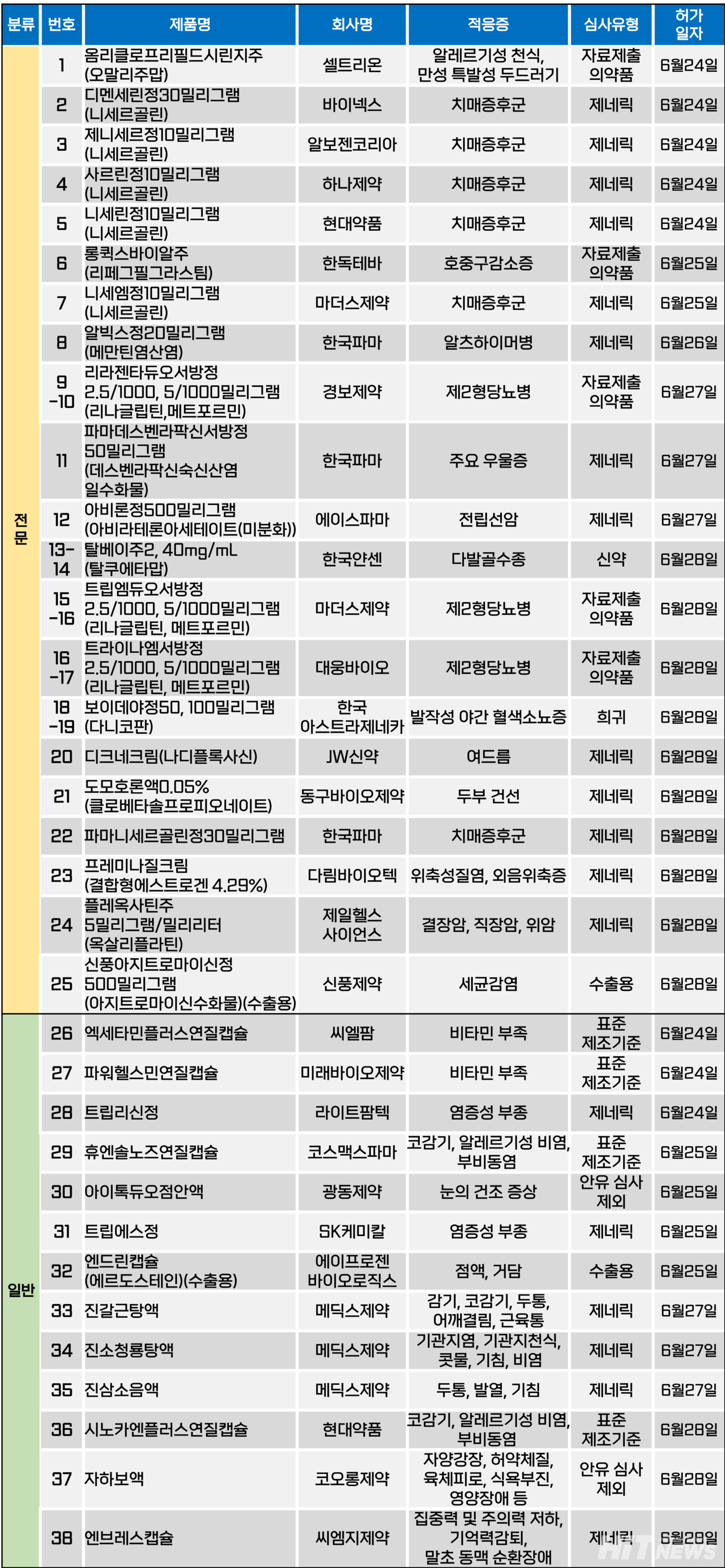
지난주(6월 24~28일) 총 38개 품목이 식품의약품안전처로부터 품목허가를 받았다. 전문의약품은 25개 품목, 일반의약품은 13개 품목이다. 이들은 알레르기성 천식, 치매증후군, 호중구감소증, 제2형당뇨병, 우울증, 전립선암, 다발골수종, 발작성 야간 혈색소뇨증 등다양한 적응증으로 허가됐다.
치매증후군 치료제로 사용되는 뇌기능개선제 성분 '니세르골린'제제품목허가가 이어지고 있다.
식약처에 따르면, 지난달 24일 △디멘세린정30밀리그램(제조사 바이넥스) △제니세르정10밀리그램(알보젠코리아) △사르린정10밀리그램(하나슬롯사이트 업카지노) △니세린정10밀리그램(현대약품), 25일 △니세엠정10밀리그램(마더스슬롯사이트 업카지노), 28일 △파마니세르골린정30밀리그램(한국파마) 등 6개 품목이 허가됐다.
니세르골린 제제는 용량에 따라 적응증이 달라지는데5, 10㎎은 ①뇌경색 후유증에 수반되는 만성뇌순환장애에 의한 의욕저하의 개선 ②노인 동맥경화성 두통 ③고혈압의 보조요법 등으로 허가돼 있으며, 30㎎은 일차성 퇴행성 혈관치매 및 복합성치매와 관련된 기억력 손상, 집중력장애, 판단력장애, 적극성 부족 등 치매증후군의 일차적 치료를 목적으로 사용될 수 있다.
니세르골린 제제는 기존 뇌기능개선제 △콜린알포세레이트 △아세틸-L-카르니틴 △옥시라세탐 등 성분이 임상재평가에 실패한 것을 계기로 슬롯사이트 업카지노사들의 관심을 받기 시작했다.
이번 허가로 국내 니세르골린 제제는 원료와 수출 품목을 제외하고 총 47개 품목이 됐다. 또, 10, 30㎎ 제품 포트폴리오를 모두 확보한 업체는 △마더스슬롯사이트 업카지노 △종근당 △알보젠코리아 △일동슬롯사이트 업카지노 △하나슬롯사이트 업카지노 △한미약품 △현대약품 △환진슬롯사이트 업카지노 등으로 확대됐다. 다만, 아직 5㎎ 제품을 보유한 업체는오리지널 제품 '사미온정'개발사인 일동슬롯사이트 업카지노 뿐이다.
지난 3월 국내 슬롯사이트 업카지노사들이 30㎎ 제제를 대거 허가를 획득하고, 4월 이들이 급여 적용됨에 따라 최근 본격적인 판매 경쟁을 예고한 바 있다.
다만, 지난 5월까지 본격적인 원외처방액 변화는 보이지 않고 있다. 의약품 시장조사기관 유비스트에 따르면, 니세르골린 제제의 전체 원외처방액은 지난 3월 약 5억 3000만원, 4월 5억 7900만원, 5월 5억5300만원 등을 기록했다.
이 중 오리지널 제품인 사미온정은 3개 용량 제품 합산 지난 3월부터 약 4억7000만원, 4월 5억원, 5월 4억7121억원 등으로 집계됐으며, 한미약품 '니세골린'2개 용량 제품이 매달 6000만원대 수준의 처방액을 올리고 있는 것으로 나타났다.
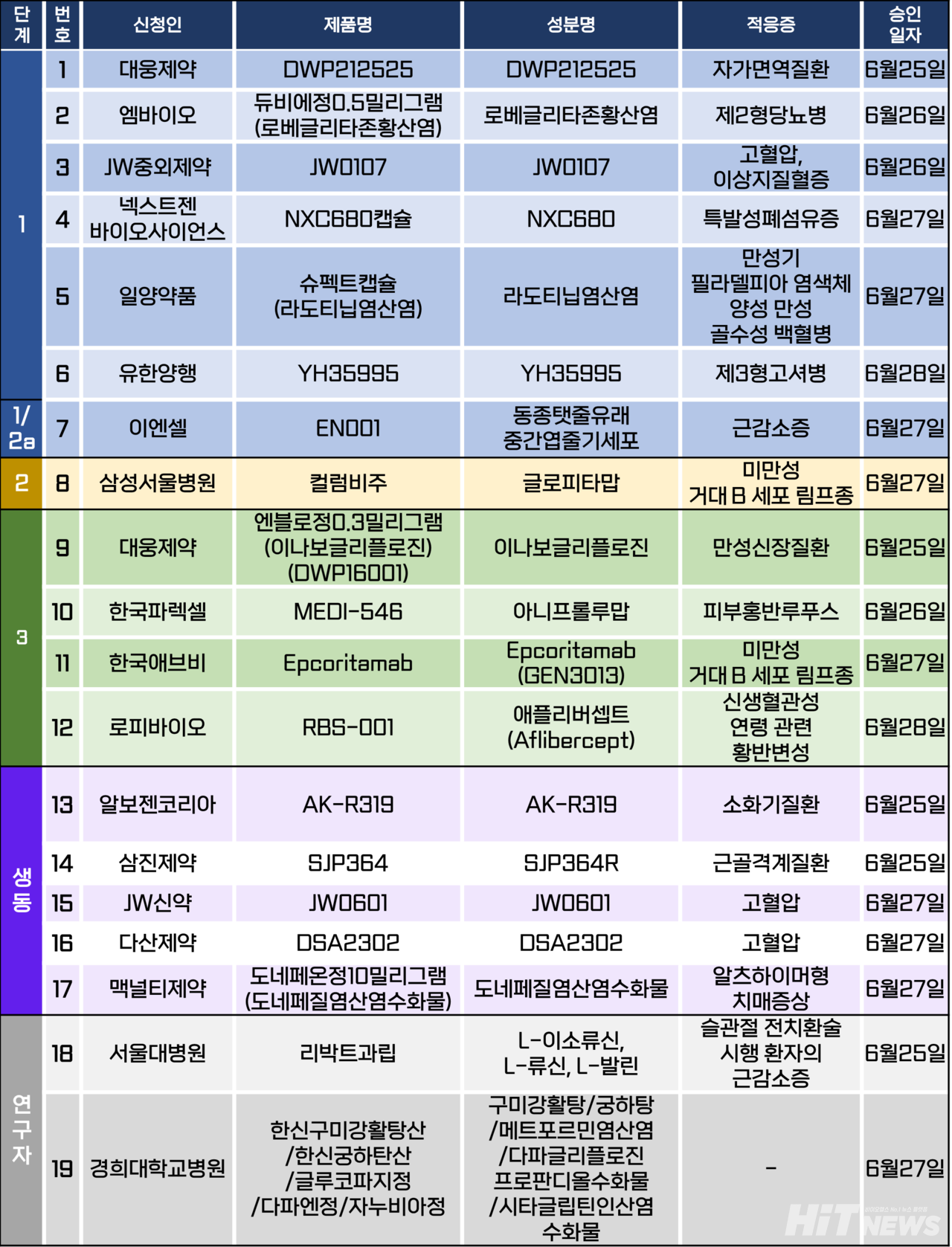
임상시험계획은 총 19건이 승인됐다. 세부적으로 △1상 6건 △1/2a상 1건 △2상 1건 △3상 4건 △생물학적 동등성 5건 △연구자임상 2건 등이다. 이 임상시험들은 자가면역질환, 고혈압, 이상지질혈증, 제2형당뇨병, 이상지질혈증, 제3형고셔병, 근감소증, 만성신장질환, 피부홍반루푸스, 신생혈관성 연령 관련 황반변성 등 질환과 필라델피아 염색체 양성 만성 골수성 백혈병, 미만성 거대 B세포 림프종 등 암종을 대상으로 승인됐다.
아미코젠의 관계사 로피바이오가 미국, 유럽에 이어 국내에서도 3상 임상시험을 시작한다. 회사가 개발중인 아일리아 바이오시밀러인 'RBS-001(개발코드명)'의 3상 임상시험계획이 지난달 28일 식품의약품안전처로부터 승인됐다.
회사는 RBS-001의 개발을 위해 지난 1월 미국 FDA에, 지난 2월 유럽 EMA에 3상 임상시험계획서를 제출했고, 각 3월, 5월 승인된 바 있다. 국내에서도 작년 12월 이를 제출했는데, 이번 승인은 이와 관련된 것이다.
이번 3상 임상은 신생혈관성(습성) 연령 관련 황반변성이 있는 시험대상자에서 RBS-001와 아일리아(성분 애플리버셉트) 간의 유효성, 안전성, 내약성 및 면역원성을 비교하기 위한 연구로, 국내 36명(글로벌 434명)의 환자를 대상으로 가톨릭대 성모병원에서 진행된다. 예상 목표기한은 2026년 3월까지다.
연구진은 안구당 1회 2㎎(50㎕)의 임상시험용의약품을 4주 간격으로 3회 시험대상자 유리체강 내 투여(IVT)한다. 이후 8주마다 5회 반복 투여해 총 8회 투여하게 된다.
이번 임상의 일차유효성평가변수는 △베이스라인(제1일) 대비 임상시험용 의약품 투여 8주 후 ETDRS(Early treatment of diabetic retinopathy study) 글자 점수로 측정한 BCVA(최대 교정 시력)의 변화이며, 주요 이차유효성평가변수는 △베이스라인 대비 임상시험용 의약품 투여 후 4주, 8주, 12주, 16주, 20주, 24주 시점에서 ETDRS 글자 점수로 측정한 BCVA의 변화다.
한편, 국내에서 이미 2개 품목의 아일리아 바이오시밀러가 허가된 바 있다.
가장 먼저 허가를 획득한 시밀러는 삼성바이오에피스의 '아필리부'다. 아필리부는 지난 2월 23일 허가됐으며, 삼일슬롯사이트 업카지노과 국내 판매 파트너십을 체결해 지난 5월 출시한 바 있다.
또 다른 시밀러 보유 슬롯사이트 업카지노사는 셀트리온이다. 셀트리온은 지난 5월 30일 자사 '아이덴젤트'를 허가 받았고, 계열사인 셀트리온슬롯사이트 업카지노이 출시 후 국내 유통을 맡는다.
아직 품목허가 획득까지 달성하지는 못했지만, 아일리아 시밀러 개발에 선두중인 업체로 삼천당슬롯사이트 업카지노이 있다. 회사는 자사 'SCD411(개발코드명)'의 3상 임상시험을 마치고, 작년 11월 식약처에 품목허가를 신청 후 심사를 진행중이다.
관련슬롯사이트 업카지노
- '원장님, 콜린 대신 저희 제품 쓰시면 삭감도 없고 참 좋은데...'
- 콜린 대체품으로 주목끌던 니세르골린 막상 나오고 보니 '지지부진'
- 뇌기능개선제 퇴출 풍선효과 '니세르골린' 26품목 대거 등재
- [허가/임상] 17개 슬롯사이트 업카지노사 '니세르골린' 후발약 경쟁 합류
- 셀트리온, 아일리아 시밀러 '아이덴젤트' 국내 품목허가
- 황반변성 선호 약제 '아일리아', '바비스모' 등장후 판도 변화 주목
- 삼일슬롯사이트 업카지노·삼성바이오에피스, 황반변성치료제 '아필리부' 출시
- 프리필드시린지 만드는데 4년… 삼천당, 아일리아시밀러 특허도전 '3전4기'

