대한민국 신약개발 지도 - 해시 게임 바카라
[끝까지 HIT 9호]나를 나답게, 너를 너답게, 나를 인간답게 만드는 요소는 과거의 자취요, 지난 날에 대한 기억이다. 어린 시절 놀러갔던 시골 할머니, 할아버지 댁의 정취, 스쳐간 애틋한 인연, 죽도록 일하고 공부했던 시절은 한 인간을 구성하고 정의한다.
그래서 해시 게임 바카라에 걸린다는 건, 기억을 빼앗긴다는 건, 존재를 빼앗기는 것이나 다름없다. 단골로 다녔던 맛집, 오랜 친구와의 약속, 사랑하는 자식의 얼굴은 망각의 썰물에 스러진다. 그렇게 나를 나답게 만들었던 모든 순간들은 새까만 구멍이 되어 한 인간을 송두리째 집어삼킨다. 단언컨대 해시 게임 바카라는 인간이 걸릴 수 있는 최악의 질병이다.
인류는 망각이란 거악(巨惡)에 맞서 최선의 노력을 경주해왔다. 그리고 비록 완승하진 못했어도 의미 있는 성과를 올리고 있다. 그 거악은 어떤 존재일까. 그리고 우리는 어떤 결실을 맺었을까. 그 투병기를 복기해 본다.

대한민국은 이제 '해시 게임 바카라 공화국'을 향해 질주하고 있다. 보건복지부 중앙해시 게임 바카라센터의 '대한민국 해시 게임 바카라현황 2022'보고서에 따르면, 올해 예상되는 국내 해시 게임 바카라 환자수는 100만명에 이른다. 유병률도 높은 편으로, 65세 이상 인구 9명 중 1명은 해시 게임 바카라를 앓고 있다. 본격적인 인구 고령화가 시작되며 대표적인 노인성 질환인 해시 게임 바카라가 덩달아 따라붙기 시작했다는 분석이다.
해시 게임 바카라환자 1인당 연간 관리비용도 증가세다. 2010년 1인당 관리비용은 1851만원이었으나, 2021년에 이르러 2112만원으로 늘었다. 국가해시 게임 바카라관리비용도 같은 추세를 보여, 2017년 14.2조원에서 2021년 18.7조원으로 약 32% 증가했다.
해시 게임 바카라는 결국 알츠하이머병을 지칭한다. 모든 해시 게임 바카라가 알츠하이머병에서 비롯되진 않지만, 해시 게임 바카라가 있는 환자의 60~70%는 알츠하이머병을 앓는다.
알츠하이머병의 정확한 질병 기전은 100% 규명된 상태가 아니다. 하지만 학계가 인정하는 가장 유력한 원인은 '아밀로이드 베타(Aβ)'다. 아밀로이드 베타라는 물질이 뇌 속에 축적되며 신경세포 간 소통을 막고 세포 괴사를 일으킨다는 것이다.
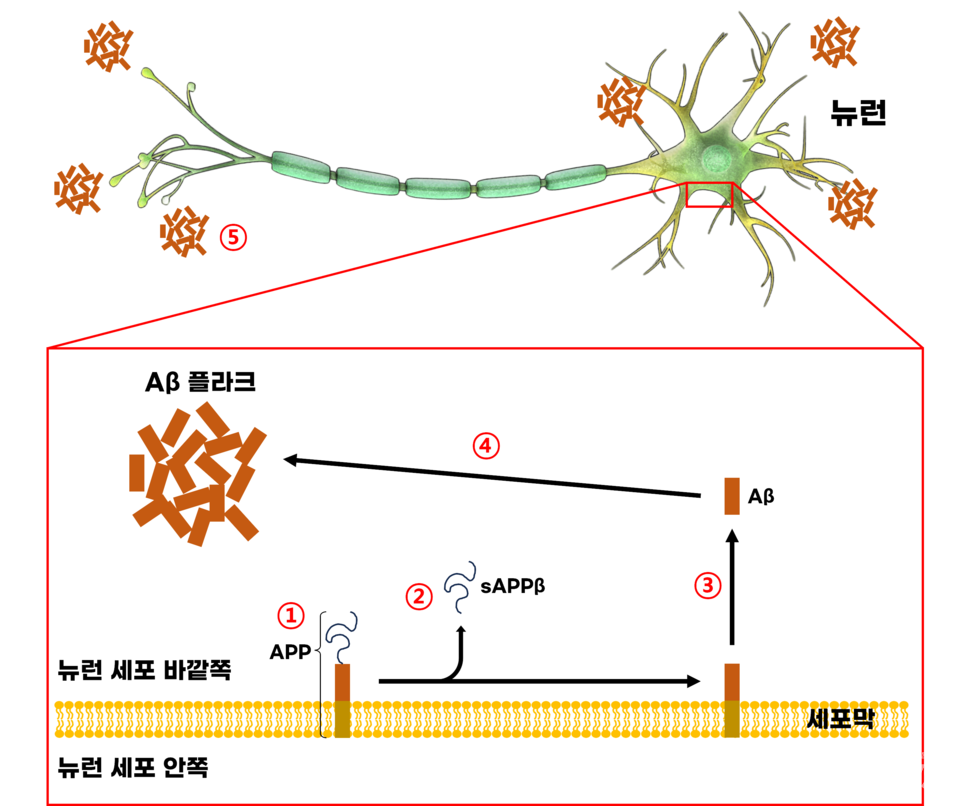
아밀로이드 베타가 알츠하이머병을 일으키는 수순은 다음과 같다.
①뉴런의 세포막에는 APP(Amyloid precursor protein)라는 단백질이 항시 존재한다.
②이 단백질에 베타 분비효소(beta secretase)가 다가와 APP를 자른다. 잘려나간 부분인 sAPPβ는 큰 이상 없이 자연적으로 분해된다.
③아직 세포막에 박혀 있는 APP의 잔해에 감마 분비효소(gamma secretase)가 다가와 잔해를 자른다.
④잘려나간 부분인 아밀로이드 베타(Aβ)는 서로 접착되며 응집해 덩어리를 이룬다. 이를 플라크(plaque)라 한다.
⑤아밀로이드 베타 플라크가 뉴런과 뉴런 사이에 간섭하면서 신호전달을 방해한다. 플라크는 염증반응까지 유도하며 세포 괴사를 일으킨다.

현재 국내에 허가된 알츠하이머병 치료제는 크게 2종류로, 콜린에스테라아제 억제제와 NMDA 길항제가 있다. 콜린에스테라아제 억제제로는 도네피질(Donepezil), 리바스티그민(Rivastigmine), 갈란타민(Galantamine)이 있으며, NMDA 길항제로는 메만틴(Memantine)이 쓰인다.
다만 이 약물들은 작용 기전 상 해시 게임 바카라의 근본적인 병리에 간섭하지 못한다. 일종의 대증요법으로써 기능하는 것이 그 효과의 전부로, 질병의 진행을 늦추거나 멈추지는 못한다는 한계가 있다.
유수의 제약사들은 이러한 한계를 극복하고자 새로운 전략을 꺼내들었다. 전술했던 '아밀로이드 베타 가설'을 통해 알츠하이머병을 치료하는 방법을 찾기 시작했다. 그리고 2021년을 기점으로 소기의 성과가 나타나기 시작했다.
가장 먼저 등장한 해시 게임 바카라 신약은 바이오젠(Biogen)사의 '아두헬름(ADUHELM)'이다. 2021년 6월 미국 식품의약국(FDA)으로부터 신속 승인을 받았다. 아밀로이드 베타를 제거하는 방식을 택한 최초의 치료제로, 개발 단계부터 큰 관심을 모았던 약물이다. 그러나 효능 자체에 문제가 있다는 논란이 일며 상업화에 고전했고, 바이오젠은 결국 지난 2월경 아두헬름 상업화를 포기했다.
아두헬름의 실패에도 불구, 바이오젠은 에자이(Eisai)와 공동개발한 '레켐비(LEQEMBI)'를 시장에 내놓기에 이른다. 레켐비 또한 아두헬름과 같이 신속 승인을 통해 작년 7월에 허가가 이뤄졌지만, 임상 3상에서 인지기능 저하 예방효과를 보이는 등 실질적인 약효가 관찰됐다. 국내 허가는 올해 상반기 내 이뤄질 것으로 예상된다.
레켐비에 이어 숨가쁘게 뒤따라온 '도나네맙(Donanemab)'은 FDA의 허가 심사를 거치는 중이다. 업계는 작년 말까지는 허가가 이뤄질 것으로 예상했으나, 모종의 이유로 FDA에서 심사가 연기되고 있다. 연내 FDA 허가가 이뤄질 경우 내년~2026년 경 국내 도입이 가능해질 전망이다.

