카지노 꽁 머니, 유지요법 시 투여 간격 8주, 자가 주사 가능
화이자, 경구용 선택적 CDK4 억제제 'PF-07220060' 2상 승인
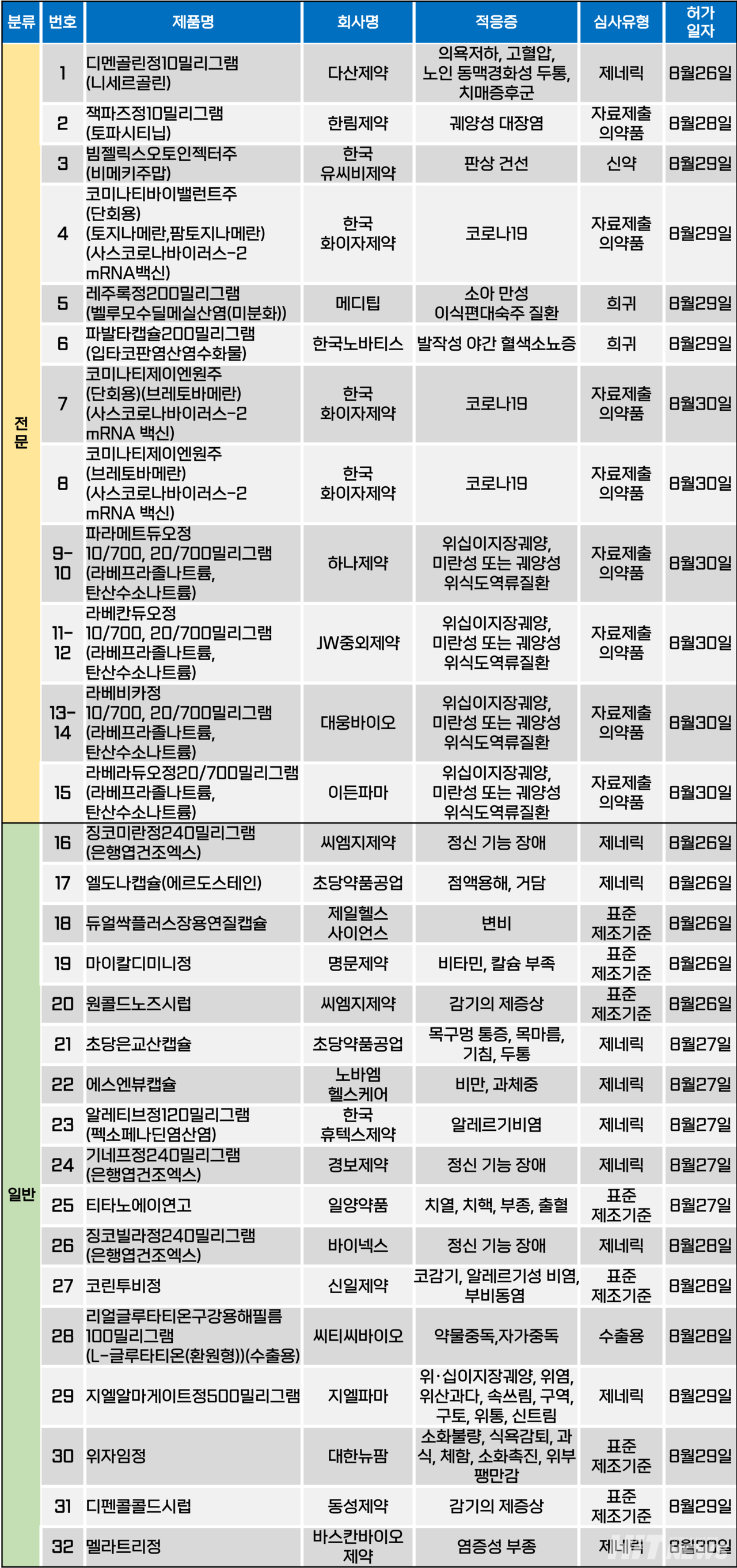
지난주(8월 26~30일) 총 32개 품목이 식품의약품안전처에서품목허가를 받았다. 전문의약품은 15개, 일반의약품은 17개 품목이다. 이들은 치매증후군, 코로나19 감염, 소아 만성 이식편대숙주질환, 위·십이장궤양, 위식도역류질환, 발작성 야간 혈색소뇨증 등 다양한 적응증으로 허가됐다.
유씨비(UCB)가 개발한 판상건선 치료제 '카지노 꽁 머니(성분 비메키주맙)'이 지난달 29일 식약처로부터 품목허가를 획득했다.
카지노 꽁 머니는 건선 염증 과정의 중추적 역할을 하는 사이토카인(Cytokine) '인터루킨-17A(IL-17A)'와 '인터루킨-17F(IL-17F)'에 모두 작용하는 첫 이중 작용 억제제로, 광선요법 또는 전신치료요법을 필요로 하는 중등도에서 중증의 성인 판상 건선 환자의 치료 목적으로 허가됐다.
카지노 꽁 머니의 용법용량은 처음 16주 동안 4주마다 피하주사로 320mg을 투여하고, 이후에는 8주마다 같은 용량을 투여한다. 병원에서 투여 받거나 교육을 통해 직접 자가 주사할 수 있다.
허가 주요 임상인 'BE READY'연구 결과, 투약 16주차에 'PASI 90(90% 피부 증상 개선)'에 도달한 환자는 카지노 꽁 머니 투여군이 90.8%, 'PASI 100(100% 피부 증상 개선)'인 환자는 68.2%로 나타났다. 또한 IGA 점수 0 또는 1('깨끗함' 또는 '거의 깨끗함')을 달성한 환자는 카지노 꽁 머니 투여군의 92.6%였으며, 이는 위약군이 1.2% 대비 유의하게 높은 것으로 나타났다(p<0.0001).
또한 다른 생물학적제제와 비교한 3상연구에서, 16주차에 PASI 100에 도달한 환자 비율은 △카지노 꽁 머니군 59% vs 우스테키누맙군 21%(BE VIVID) △카지노 꽁 머니군 60.8% vs 아달리무맙군 23.9%(BE SURE) △카지노 꽁 머니군 61.7% vs 세쿠키누맙군 48.9%(BE RADIANT)로 나타났다.
이 중 BE RADIANT 임상에서 카지노 꽁 머니는 최초 1회 투여 후 4주 만에 71% 환자가 PASI 75를 달성한 것으로 나타나, 47.3%를 보인 세쿠키누맙군 대비 투여 후 빠른 치료 유효성을 보였다.
회사 측에 따르면, 다수의 3상 임상시험을 통해 확인된 카지노 꽁 머니의 PASI 100 도달률은 BE BRIGHT 공개연장연구 결과 3년간 유의미한 수준으로 유지된 것으로 나타났다. 또, BE VIVID, BE SURE, BE RADIANT 연구에서 16주차에 PASI 100을 달성했던 환자의 82%는 3년차에도 PASI 100 상태를 유지한 것으로 나타났다.
16주차에 PASI 100을 달성한 환자들의 삶의 질 척도 지수(DLQI-Dermatology Life Quality Index)에서 0 또는 1을 나타낸 환자는 16주차 76.3%에서 카지노 꽁 머니 치료 3년차에 89.0%까지 증가한 것으로 나타났다.
한국유씨비제약 황수진 대표는 이번 카지노 꽁 머니의 국내 허가와 관련 "다수의 임상시험에서 카지노 꽁 머니의 장기 치료가 건선 환자들의 삶의 질에 중요한 이점을 제공하는 것이 확인된 만큼, 이를 바탕으로 국내 많은 건선 환자들이 카지노 꽁 머니로 깨끗한 피부를 회복하고 더욱 높은 삶의 질을 영위하기를 바란다"며 "카지노 꽁 머니의 신속한 건강 보험 등재를 통해 환자 및 의료진들이 카지노 꽁 머니를 사용함에 제한이 없도록 최선의 노력을 기울일 것"이라고 전했다.
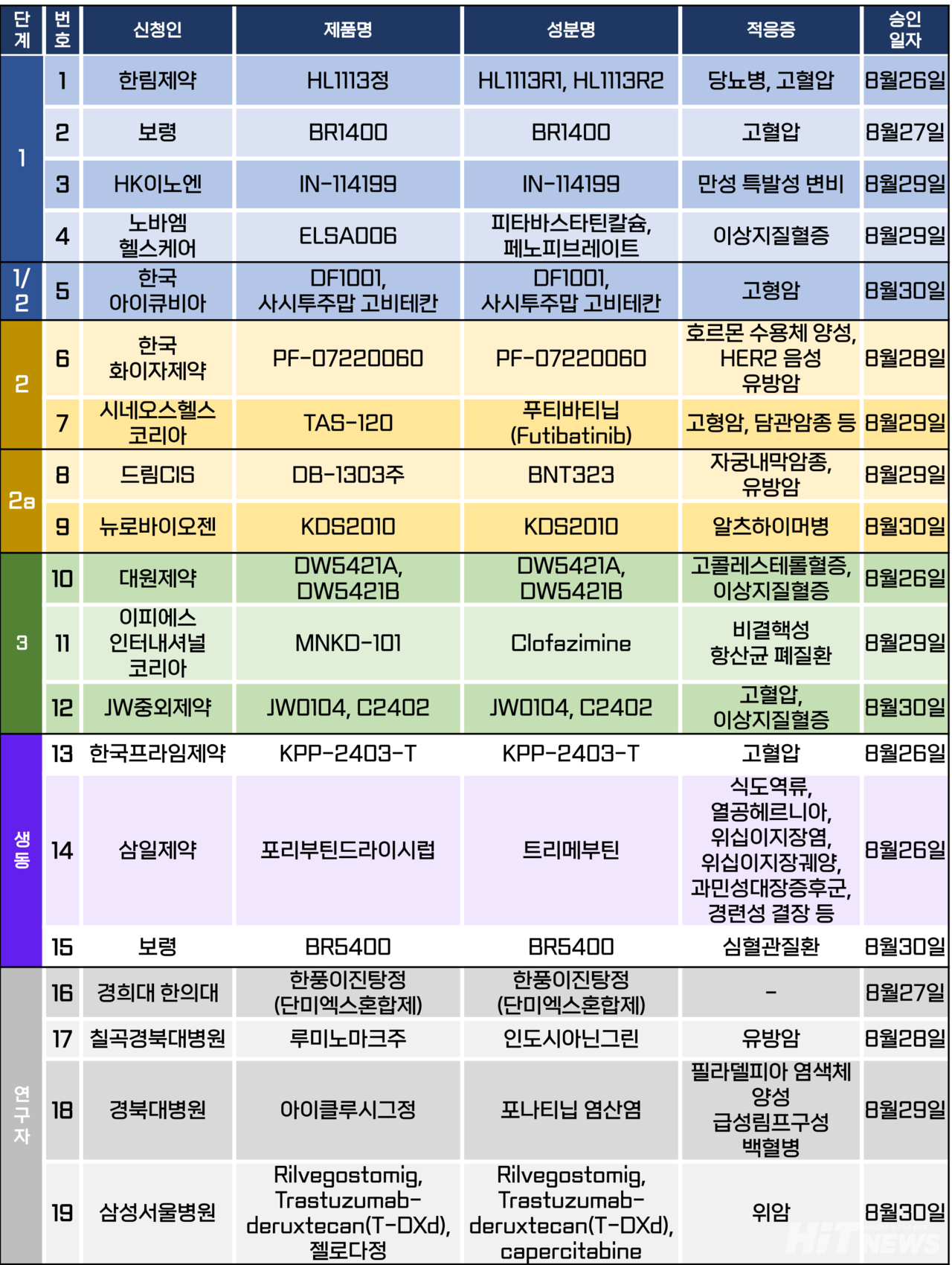
임상시험계획은 총 19건이 승인됐다. 세부적으로 △1상 4건 △1/2상 1건 △ △2상 2건 △2a상 2건 △3상 4건 △생물학적 동등성 3건 △연구자임상 4건 등이다. 이 임상시험들은 당뇨병, 고혈압, 만성 특발성 변비, 알츠하이머병, 이상지질혈증, 비결핵성 항산균 폐질환 등 질환과 유방암, 담관암, 위암 등 암종을 대상으로 승인됐다.
화이자가 개발 중인 경구용 선택적 CDK4 억제제 'PF-07220060'의 2상 임상시험계획이 지난달 28일 승인됐다.
PF-07220060은 회사가 보유한 CDK4/6 억제제 '입랜스(성분 팔보시클립)'와 마찬가지로 호르몬 수용체 양성, HER2 음성 유방암 환자를 대상으로 개발되고 있다.
이번 2상 임상은 호르몬 수용체 양성, HER2 음성 유방암 환자인 18세 이상 폐경 후 여성에서 선행 항암보조요법으로서의 PF-07220060과 레트로졸의 병용요법과 레트로졸 단독요법을 비교하는 중재적, 공개라벨, 무작위 배정, 다기관 연구다.
국내 환자 8명(글로벌 118명)의 참여를 목표로 2025년 10월까지 △세브란스병원 △서울아산병원 △서울대병원 등 의료기관에서 진행될 예정이다.
연구의 일차유효성평가변수는 △제14일 시점의 CCCA(완전한 세포 주기 정지) 비율(Ki 67 ≤2.7%), 이차유효성평가변수는 △모든 이상반응(AE), 심각한 이상반응(SAE), 시험약 중단을 초래한 AE의 발생률 △베이스라인 및 제14일 시점의 ctDNA 측정치 △PF-07220060의 Ctrough(혈청 최저 농도) 및 생검 전후 혈장 농도 △Ki-67 염색 등이다.
한편, 화이자는 PF-07220060와 선택적 에스트로겐 수용체 분해제(SERD) ‘풀베스트란트 제제와의 병용요법을 대상으로 3상 임상시험을 진행중에 있다. 29개국 356개 의료기관에서 약 500명의 환자를 대상으로 진행 중인 이 연구는 PF-07220060+풀베스트란트 병용요법과 풀베스트란트 단독요법 그리고 에베로리무스+에제메스탄 병용요법의 안전성 및 유효성을 비교한다.
관련카지노 꽁 머니
- 화이자, 입랜스 국내 허가 6주년 기념 사내행사 개최
- 유방암 치료제 시장, HER2 → CDK4/6 억제제로
- 유씨비 '빔젤스', 판상 건선 치료제로 허가 준비…2025년 출시 목표
- 존슨앤드존슨 "IL-23 억제제 건선 3상 효능·안전성 확인"
- IL-17A/F 이중 억제제 '카지노 꽁 머니' 판상 건선 미충족 수요 개선 기대
- 올해 신약 2개 허가 '유씨비', 기세 몰아 내년 2개 품목 추가
- PASI 100 (complete sk슬롯 사이트 슬롯사이트 clearance at 16
- UCB Eyes Two More Approvals After This Year’s Success

